CATEGORIES:
BiologyChemistryConstructionCultureEcologyEconomyElectronicsFinanceGeographyHistoryInformaticsLawMathematicsMechanicsMedicineOtherPedagogyPhilosophyPhysicsPolicyPsychologySociologySportTourism
L'expérience 3. La détérmination quantitative de l'ammoniaque dans l'urine selon Malfatti.L'expérience 1. La réaction biurétique sur l'urée. On place quelques cristaux de l'urée à l'éprouvette sèche et on les fond sur la flamme jusqu’au durcissage de la masse fondue. De l’urée se détache l'ammoniaque et se forme le biuret. On découvre l'ammoniaque selon l'odeur et selon la couleur bleu dans les vapeurs du papier de tournesol rouge mouillé par l’eau. On refroidit le biuret reçu dans l'éprouvette, puis on dilue dans 0,5 ml 10% de la solution d’hydroxyde du sodium et on ajoute 1-2 gouttes de 1% de la solution de soulfate du cuivre. La peinture rose est conditionnée par la formation du sel du cuivre complexe du biuret. L'expérience 2. La détérmination quantitative de la créatinine dans l'urine selon la réaction colorée d'Yaffe (la méthode de Popper). La créatinine, en coopérant avec la forme quinoïque de l'acide picrique, forme le picrate de la créatinine, qui dans le milieu basique se transforme à la forme tautomérique ayant la couleur rouge orange. L'intensité de la coloration est proportionnelle à la concentration de la créatinine.
Au matras mesuré sur 100 ml on mesure de la quantité de vingt-quatre heures 0,5 ml d’urine et 3 ml de la solution saturée de l'acide picrique. On secoue et on ajoute 0,2 ml de 10% de la solution d’hydroxyde du sodium. On laisse pour 10 minutes à la température ordinaire, après quoi par l'eau distillée on mène le volume jusqu'à 100 ml. On mesure la densité optique sur le photoélectrocolorimètre dans la cuvette avec l'épaisseur de la couche de 1 cm à la longueur d'onde 510-560 nm (le filtre vert) contre le contrôle. On met simultanément l'essai de contrôle. Au matras mesuré sur 100 ml on mélange 3 ml de la solution saturée de l'acide picrique et 0,2 ml de 10% de la solution d’hydroxyde du sodium, on mène par l'eau à la marque. L'essai standard. Au matras mesuré sur 100 ml on verse 0,5 ml de la solution essentielle standarde de la créatinine et 3 ml de la solution saturée de l’acide picrique. On secoue et on ajoute 0,2 ml de 10% de la solution d’hydroxyde du sodium. Ensuite on travaille les essais de la même façon que l'expérience. On produit le compte selon la formule :
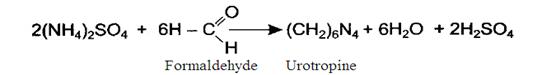
où ő - la quantité de créatinine dans l'urine de vingt-quatre heures, mg; Ń Comparer les donnés reçus avec les valeurs normales du contenu de la créatinine dans l'urine de vingt-quatre heures. En norme le contenu de la créatinine dans l'urine chez les hommes est égal 1-2 g/24 heures (8,8-17,7 mmol'/24 heures), chez les femmes - 0,8-1,8 g/24 heures (7,1-15,9 mmol'/heures). L'expérience 3. La détérmination quantitative de l'ammoniaque dans l'urine selon Malfatti. Les sels d’ammonium se forment à la neutralisation des acides par l'ammoniaque, entrant dans l'organisme du dehors ou se formant dans l'organisme dans les procès du métabolisme. Dans l'aspect des sels d’ammonium dans la norme avec l'urine pour 24 heures se dégage 0,5-1,2 g de l'ammoniaque. Le dégagement de l'ammoniaque avec l'urine considérablement augmente aux maladies accompagnées par l'acidose, par exemple, au diabète sucré, quand se forment les corps de céton (l'acide acétoacétique, b-hydroxybutyrique acide) et augmente la quantité des acides phosphoriques et sulfuriques en rapport avec le renforcement de la désagrégation des protéines de tissu. La réduction de la quantité d'ammoniaque dans l'urine est caractéristique pour la défaite des reins aux frais de perte de la capacité de recevoir l'ammoniaque de la glutamine. On mesure au matras 5 ml d'urine, on ajoute 25 ml de l'eau distillée, 2 gouttes de la solution du phénolphtaleine et on fait le titrage par 0,1 n. la solution d’hydroxyde du sodium jusqu’à l'apparition de la coloration faiblement rose. On atteint la neutralisation des substances du caractère acide se trouvant dans l'urine. On ajoute 2 ml de formaline. Le mélange se décolore en conséquence de la décomposition des sels ammoniacaux et de l'apparition dans la solution de l'acide.
On fait de nouveau le titrage du mélange par 0,1 n. la solution de NaOH jusqu’à la peinture rose. On multiplie la quantité de millilitres dépensés au dernier titrage sur 0,0017 (le titre 0,1 n. de la solution de l'ammoniaque) on reçoit la masse d’ammoniaque dans le volume pris pour l'analyse de l'urine. Comptez, combien d'ammoniaque était dégagé avec l'urine pour 24 heures, si son volume de vingt-quatre heures est 1200 ml. Faites la conclusion sur la présence ou l'absence de l'acidose.
Date: 2016-01-05; view: 286
|

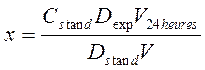
 - la quantité de créatinine dans l'essai standard, mg; D
- la quantité de créatinine dans l'essai standard, mg; D 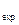 - la densité optique de l'essai expérimenté; D
- la densité optique de l'essai expérimenté; D 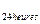 - la quantité de vingt-quatre heures d'urine; V - la quantité de l'urine prise pour l'analyse.
- la quantité de vingt-quatre heures d'urine; V - la quantité de l'urine prise pour l'analyse.